|
disseminiert
|
Disseminiert (von lat. *disseminare* = „ausstreuen“) bezeichnet in der Medizin eine weite, verstreute Ausbreitung von pathologischen Prozessen im Gewebe oder Organismus, meist in Abgrenzung zu fokalen oder lokalisierten Veränderungen.
Verwendung in der Medizin
- Disseminierte Metastasierung: Tumorzellen sind multifokal in mehreren Organen nachweisbar, z. B. bei fortgeschrittenem Mamma- oder Bronchialkarzinom.
- Disseminierte Infektion: Infektiöse Erreger verbreiten sich über Blut oder Lymphbahnen, z. B. disseminierte Tuberkulose oder disseminierte Candidiasis.
- Disseminierte intravasale Gerinnung (DIC): Systemische Aktivierung der Gerinnung mit Mikrothromben in vielen Organen.
Abgrenzung
- Fokal: auf einen umschriebenen Herd begrenzt.
- Lokalisiert: auf ein bestimmtes Organ oder eine Region beschränkt.
Synonyms -
disseminierte,disseminiertes,disseminierter
|
|
DNA-Methylierung
|
DNA-Methylierung ist eine epigenetische Modifikation, bei der Methylgruppen (-CH3) durch DNA-Methyltransferasen (DNMTs) an Cytosinreste in CpG-Dinukleotiden angefügt werden. Sie beeinflusst die Genexpression, ohne die DNA-Sequenz zu verändern, und spielt eine zentrale Rolle in der Genregulation, Zellentwicklung und Krebsentstehung.
Mechanismus
- Hypermethylierung: Führt zur Stilllegung von Tumorsuppressorgenen (z. B. MLH1, CDKN2A)
- Hypomethylierung: Kann zur Aktivierung von Onkogenen oder genomischer Instabilität führen
Bedeutung in der Onkologie
- Hypermethylierung von MLH1 → Mikrosatelliteninstabilität (MSI) bei kolorektalem Karzinom
- PTEN- und BRCA1-Methylierung → Tumorprogression
- Globale Hypomethylierung → Erhöhte Chromosomeninstabilität
- Methylom-Analysen: Identifikation tumorspezifischer Methylierungsmuster zur Klassifikation und Prognoseabschätzung (z. B. MGMT-Promotormethylierung bei Glioblastomen, CNS-Tumor-Methylom-Subtypisierung)
Klinische Relevanz
- Diagnostischer Marker für Tumoren (z. B. MGMT-Methylierung bei Glioblastomen)
- Therapeutische Angriffsfläche für DNMT-Inhibitoren wie Azacitidin (MDS, AML)
- Wichtiger Biomarker zur personalisierten Therapieplanung
|
|
DNA-Mismatch-Reparaturmechanismus
|
Der DNA-Mismatch-Reparaturmechanismus (MMR) ist ein zelluläres Reparatursystem, das fehlerhaft gepaarte Basen korrigiert, die während der DNA-Replikation entstehen. Es erkennt und entfernt Basenfehlpaarungen sowie Insertionen oder Deletionen in repetitiven Sequenzen und stellt die korrekte DNA-Sequenz wieder her. Ein funktionierendes MMR-System ist essenziell für die genetische Stabilität. Dysfunktionen in diesem Mechanismus führen zu einer Anhäufung von Mutationen, insbesondere in Mikrosatelliten-Sequenzen, was als Mikrosatelliteninstabilität (MSI) bekannt ist. Defekte im MMR-System sind häufig mit hereditären Tumorsyndromen wie dem Lynch-Syndrom sowie verschiedenen sporadischen Krebserkrankungen, insbesondere kolorektalen und endometrialen Karzinomen, assoziiert. Tumoren mit MMR-Defizienz weisen oft eine hohe Mutationslast auf, was sie anfälliger für bestimmte Therapieansätze macht. Der MMR-Status ist daher ein wichtiger Biomarker für die Diagnose, Prognose und Therapieplanung, insbesondere im Kontext der Immuntherapie.
Synonyms -
MMR,DNA-Mismatch-Reparatur
|
|
DNA-Schädigung
|
DNA-Schädigung bezeichnet strukturelle Veränderungen der Desoxyribonukleinsäure (DNA), die durch exogene oder endogene Einflüsse entstehen und die genetische Integrität gefährden.
Ursachen
Typen von DNA-Schäden
- Basenmodifikationen
- Einzelstrangbrüche (SSB)
- Doppelstrangbrüche (DSB)
- Quervernetzungen, Pyrimidindimere, Crosslinks
Pathophysiologische Bedeutung
- Führt unbehandelt zu Mutationen, Genominstabilität und Karzinogenese
- Zellen reagieren mit Zellzyklusarrest, Apoptose oder DNA-Reparaturmechanismen
Klinische Relevanz
- DNA-Schädigung ist Ziel vieler Krebsmedikamente (z. B. Platinverbindungen, Alkylanzien)
- Defekte in Reparaturmechanismen (z. B. BRCA-Mutationen) erhöhen die Anfälligkeit für Tumoren und sind therapeutisch nutzbar (z. B. durch PARP-Inhibitoren)
|
|
Drüsenkörperzysten
|
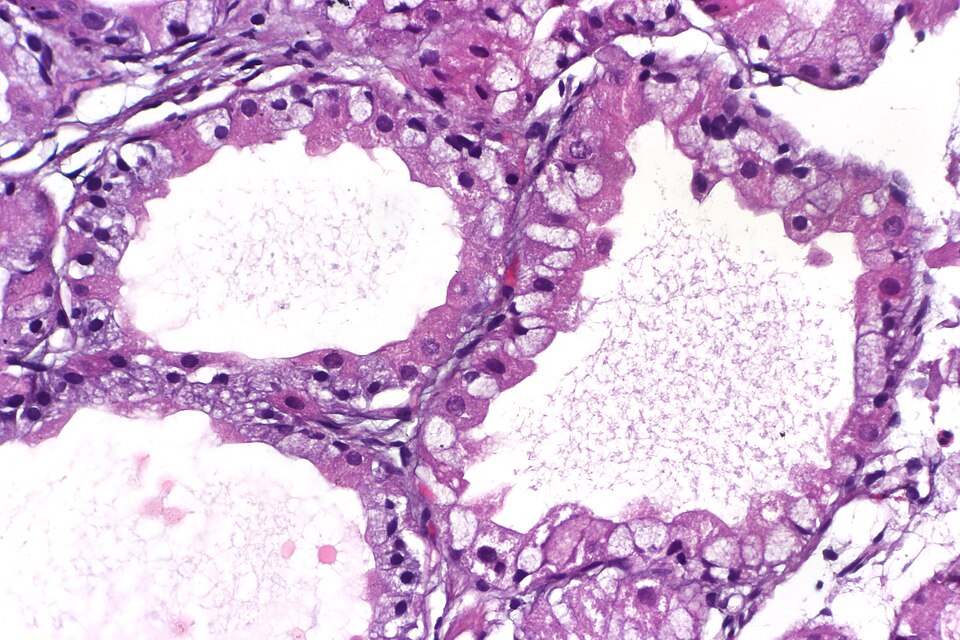
Drüsenkörperzyste
Drüsenkörperzysten sind zystisch erweiterte Fundus- oder Korpusdrüsen in der Lamina propria, ausgekleidet von unauffälligem Zylinderepithel. Es handelt sich um reaktive, nicht-neoplastische Veränderungen, die häufig als Nebenbefund in Biopsien aus dem Magen vorkommen.
Histologische Merkmale
- Rundliche, glatte Zysten mit einschichtigem Zylinderepithel
- Oft mit Parietal- und Hauptzellen, gelegentlich mit Becherzellen
- Keine Atypien oder Dysplasie
Pathogenese
- Häufig im Rahmen von chronischer Gastritis oder Regeneratprozessen
- Langzeittherapie mit Protonenpumpeninhibitoren (PPI) kann die Bildung begünstigen – durch Stimulation des Drüsenwachstums und Sekretionsstau
- Gelegentlich auch bei Helicobacter pylori-assoziierten Veränderungen
Diagnostische Relevanz
- Gutartige, nicht präkanzeröse Läsion
- Wichtig zur Abgrenzung von zystischen Neoplasien wie Fundusdrüsenpolypen oder zystischen muzinösen Läsionen
|
|
drüsig
|
Drüsen bzw. drüsig beschreibt in der Pathologie eine Gewebestruktur, die aus Zellen besteht, die in Drüsenform angeordnet sind oder sekretorische Eigenschaften besitzen. Drüsige Muster finden sich typischerweise in Organen wie der Brustdrüse, der Prostata oder dem Darm, aber auch in Tumoren, insbesondere Adenokarzinomen, die aus drüsenbildenden Epithelzellen entstehen. Drüsige Tumoren weisen häufig auf eine Herkunft aus sekretorischen Epithelien hin und zeigen unter dem Mikroskop röhrenartige, azinäre oder alveolare Strukturen.
Synonyms -
drüsiges, drüsige, Drüsen, Drüse, drüsige Differenzierung, drüsiges Wuchsmuster, Drüsenstruktur, drüsigen, Drüsenstrukturen
|
|
Dyspepsie
|
Dyspepsie beschreibt unspezifische Oberbauchbeschwerden, die mit Symptomen wie Völlegefühl, Schmerzen, Übelkeit oder Aufstoßen einhergehen. Sie kann funktionell oder organisch bedingt sein.
Ursachen
- Funktionelle Dyspepsie: Keine nachweisbare organische Ursache, oft mit gestörter Magenmotilität assoziiert
- Organische Dyspepsie: Magenerkrankungen wie Refluxkrankheit, Gastritis, Ulkus oder Helicobacter pylori-Infektion
- Medikamente: NSAIDs, Antibiotika oder Eisenpräparate als mögliche Auslöser
Klinische Relevanz
- Abklärung bei Alarmsymptomen wie Gewichtsverlust, Anämie oder Erbrechen erforderlich
- Diagnostik durch Gastroskopie, H. pylori-Testung oder Funktionsuntersuchungen
- Therapie je nach Ursache: Protonenpumpeninhibitoren, Prokinetika oder Ernährungsanpassung
Synonyms -
dyspeptische Beschwerden,Dyspeptische Beschwerden
|
|
Dysphagie
|
Dysphagie bezeichnet eine Störung des Schluckvorgangs, bei der das Kauen, Transportieren oder Schlucken von Nahrung und/oder Flüssigkeit erschwert oder schmerzhaft ist. Sie kann funktionelle oder mechanische Ursachen haben und betrifft meist den Oropharynx oder die Speiseröhre.
Klassifikation
- Oropharyngeale Dysphagie: Störung beim Einleiten des Schluckakts, z. B. bei neurologischen Erkrankungen (z. B. Schlaganfall, Parkinson)
- Ösophageale Dysphagie: Passageprobleme im Bereich der Speiseröhre, z. B. durch Stenosen, Tumoren, Achalasie
Pathologische Relevanz
- Chronische Entzündungen (z. B. Refluxösophagitis, eosinophile Ösophagitis)
- Neoplasien der Speiseröhre (z. B. Plattenepithelkarzinom, Adenokarzinom)
- Strikturen nach Verätzungen oder Bestrahlung
Klinische Relevanz
- Leitsymptom bei ösophagealen Raumforderungen
- Abklärung mittels Endoskopie, radiologischer Schluckdiagnostik oder Manometrie
- Kann mit Aspirationsgefahr und Malnutrition einhergehen
Synonyms -
Schluckstörungen,Schluckstörung
|
|
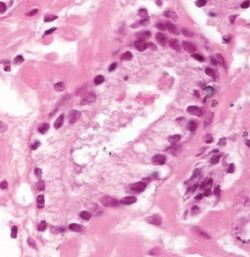
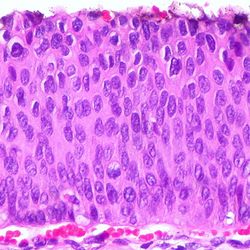
Dysplasie
|
Dysplasie bezeichnet in der Pathologie eine abnorme Zell- und Gewebestruktur, die eine Vorstufe zu malignen Veränderungen darstellen kann. Sie ist durch unregelmäßige Zellgrößen, abweichende Zellformen, veränderte Zellkerne und eine gestörte Zellarchitektur gekennzeichnet. Dysplasien entstehen häufig in Epithelgeweben und werden nach Schweregrad eingeteilt (leicht, mittel, schwer). Sie sind oft reversibel, können jedoch bei fortschreitender Veränderung zu einer präkanzerösen Läsion und letztlich zu einem Karzinom führen. Dysplasie ist daher ein wichtiger Befund in der Früherkennung von Krebserkrankungen.
Synonyms -
dysplastische, dysplastisch, dysplastisches
|
|
Dysurie
|
Dysurie bezeichnet schmerzhaftes oder erschwertes Wasserlassen. Sie ist ein häufiges Symptom, das durch Reizungen oder Entzündungen der Harnwege (z. B. bei Harnwegsinfektionen, Prostatitis oder Urethritis) verursacht wird. Typische Beschwerden sind Brennen, Stechen oder Druckgefühl während der Miktion. Dysurie kann auch bei obstruktiven oder funktionellen Störungen der Harnwege auftreten.
|
|
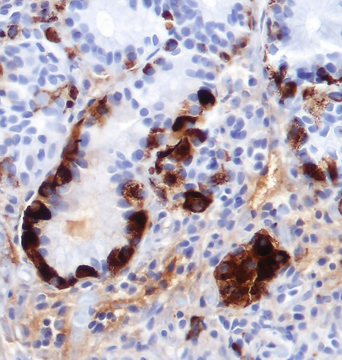
ECL-Zell-Hyperplasie
|
ECL-Zell-Hyperplasie bezeichnet eine reaktive Vermehrung der enterochromaffin-like (ECL)-Zellen im Fundus des Magens. ECL-Zellen sind neuroendokrine Zellen, die Histamin produzieren und über Gastrinrezeptoren die Magensäuresekretion stimulieren.
Pathogenese
- Stimulation durch chronisch erhöhte Gastrinspiegel (Hypergastrinämie)
- Ursachen: chronisch atrophische Gastritis (Typ A), Zollinger-Ellison-Syndrom, langfristige PPI-Therapie
Histologische Formen
- Lineare Hyperplasie: Vermehrte ECL-Zellen entlang der Basalmembran der Drüsen
- Mikronoduläre Hyperplasie: Kleine, umschriebene Zellaggregate im Korpus-Fundus-Bereich
Abgrenzung zu NET
- ECL-Zell-Hyperplasie: Reaktive, nicht-neoplastische Veränderung
- Gastrales NET: Neoplastisch, meist aus vorbestehender ECL-Hyperplasie entstanden
- Grenze: NET bei Läsionen > 0,5 mm mit destruktivem Wachstum und Umgebungsreaktion (z. B. Fibrose, Gefäßinfiltration)
Klinische Bedeutung
- Hinweis auf chronische Hypergastrinämie → Abklärung zugrunde liegender Ursache
- Kann Übergang zu Typ 1 oder Typ 2 gastralen NET markieren
Synonyms -
ECL-Zellhyperplasie
|
|
EGFR
|
EGFR (Epidermal Growth Factor Receptor, Chromosom 7p11.2) ist eine membranständige Tyrosinkinase aus der HER/ERBB-Familie. Er wird durch Bindung von Liganden wie EGF oder TGF-α aktiviert und spielt eine zentrale Rolle in Zellproliferation, Differenzierung und Überleben.
Pathologische Relevanz
- EGFR-Überexpression: Häufig bei verschiedenen Tumoren, darunter nicht-kleinzelliges Lungenkarzinom (NSCLC), Kolorektalkarzinom und Glioblastom.
- EGFR-Mutationen: Besonders relevant bei NSCLC, wo Exon-19-Deletion oder die L858R-Mutation (Exon 21) zur konstitutiven Aktivierung führen.
- Kolorektalkarzinom: EGFR kann überexprimiert sein, jedoch ist die Wirksamkeit von Anti-EGFR-Therapien wie Cetuximab oder Panitumumab abhängig vom RAS-Mutationsstatus (KRAS/NRAS-Wildtyp erforderlich).
Diagnostik
Therapeutische Relevanz
- Tyrosinkinase-Inhibitoren (TKIs): Erlotinib, Gefitinib, Osimertinib für EGFR-mutiertes NSCLC.
- Monoklonale Antikörper: Cetuximab, Panitumumab bei EGFR-positivem, RAS-Wildtyp-Kolorektalkarzinom.
- Resistenzmechanismen: T790M-Mutation im NSCLC führt zu Resistenz gegen Erstgenerations-TKIs, Ansprechen auf Osimertinib.
|
|
Ekzem
|
Ekzem (auch: Dermatitis) ist ein nicht infektiöser, entzündlicher Hautzustand, der durch Rötung, Juckreiz, Schuppung, Nässen und ggf. Bläschenbildung gekennzeichnet ist. Es handelt sich um eine häufige Reaktion der Haut auf exogene Reize (z. B. Allergene, Irritantien) oder endogene Dispositionen.
Typen (Beispiele)
- Atopisches Ekzem: Chronisch-rezidivierend, oft bei atopischer Diathese (z. B. Heuschnupfen, Asthma)
- Kontaktallergisches Ekzem: Typ-IV-Reaktion nach Allergenkontakt (z. B. Nickel, Duftstoffe)
- Irritativ-toxisches Ekzem: Durch direkte Schadwirkung von Chemikalien, häufig an Händen
- Seborrhoisches Ekzem: Fette Hautareale, assoziiert mit Malassezia-Hefen
Histologie
- Spongiose: Interzelluläres Ödem der Epidermis
- Lymphozytäres Infiltrat in der Dermis (perivaskulär)
- Intraepidermale Vesikel (bei akuten Formen)
- Hyperkeratose und Akanthose (bei chronischem Verlauf)
Klinische Relevanz
- Sehr häufige dermatologische Diagnose
- Therapie je nach Ursache: topische Kortikosteroide, Calcineurininhibitoren, Barriereschutz
- Bei allergischem Ekzem: Allergiediagnostik (Epikutantest)
Synonyms -
Dermatitis
|
|
Elektronenmikroskopie
|
Elektronenmikroskopie (EM) ist ein hochauflösendes bildgebendes Verfahren, bei dem anstelle von Licht ein Elektronenstrahl zur Darstellung von Strukturen im Nanometerbereich verwendet wird. Sie erlaubt die ultrastrukturelle Analyse von Zellen, Organellen und Pathogenen.
Typen
- Transmissionselektronenmikroskopie (TEM): Darstellung von inneren Zellstrukturen durch Elektronendurchstrahlung ultradünner Schnitte.
- Rasterelektronenmikroskopie (REM): Darstellung von Oberflächenstrukturen in 3D durch Elektronenabtastung der Probe.
Medizinische Relevanz
- Ultrastrukturelle Diagnostik z. B. bei glomerulären Erkrankungen (z. B. Minimal-Change-Nephropathie), Mitochondriopathien, Virozytosen oder Ziliopathien.
- Ermöglicht die Identifikation feinster Organellveränderungen, Einschlüsse oder Membranstrukturanomalien.
Limitationen
- Aufwändige Probenaufbereitung, lange Untersuchungszeit, hoher technischer Aufwand.
Synonyms -
EM
|
|
ELISA
|
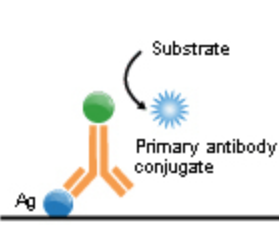
ELISA (Enzyme-Linked Immunosorbent Assay) ist ein enzymbasierter immunologischer Nachweis, der zur qualitativen und quantitativen Bestimmung von Proteinen, Antikörpern, Antigenen oder Hormonen in biologischen Proben eingesetzt wird. Er beruht auf der spezifischen Antigen-Antikörper-Reaktion und der enzymatischen Umsetzung eines Farbreagenzes.
Klinische Verwendung
- ELISA ist ein zentraler Bestandteil der serologischen Diagnostik in der Infektionsserologie, Autoimmundiagnostik und Tumormarkerbestimmung.
- Ermöglicht den hochsensitiven Nachweis von Biomarkern in Serum, Plasma, Urin oder Zelllysaten.
- Wird häufig zur Screening-Diagnostik eingesetzt, z. B. bei HIV, Hepatitis oder SARS-CoV-2.
Typen von ELISA
- Direkter ELISA: Antigenbindung direkt durch ein enzymgekoppeltes Primärantikörper.
- Indirekter ELISA: Sekundärantikörper mit Enzymmarkierung erkennt den Primärantikörper.
- Sandwich-ELISA: Erfasst Antigen zwischen zwei Antikörpern – hohe Spezifität und Sensitivität.
- Kompetitiver ELISA: Probenantigen konkurriert mit markiertem Antigen um die Bindung an den Antikörper.
Diagnostische Anwendungen
- Nachweis von Virusinfektionen (z. B. HIV, Hepatitis B/C, Dengue, SARS-CoV-2).
- Bestimmung von Autoantikörpern bei Autoimmunerkrankungen (z. B. ANA, RF, anti-dsDNA).
- Messung von Tumormarkern (z. B. PSA, CEA, CA-125).
- Quantifizierung von Zytokinen und Hormonen (z. B. IL-6, TSH).
Vorteile und Limitationen
- Vorteile: Hohe Sensitivität, Spezifität, Skalierbarkeit, einfache Automatisierung.
- Limitationen: Kreuzreaktivität möglich, Probenqualität entscheidend, meist kein Nachweis infektiöser Erreger (nur Antikörper/Antigene).
|