|
oxidativer Stress
|
Oxidativer Stress bezeichnet ein Ungleichgewicht zwischen der Produktion freier Sauerstoffradikale (reaktive Sauerstoffspezies, ROS) und der Fähigkeit des Organismus, diese durch Antioxidantien zu neutralisieren. Dies führt zu Zell- und Gewebeschäden.
Mechanismus
- Radikalbildung: Superoxid-Anion (O₂⁻), Hydroxylradikal (•OH), Wasserstoffperoxid (H₂O₂)
- Fenton-Reaktion: Eisen-katalysierte Umwandlung von H₂O₂ in hochreaktive Hydroxylradikale → DNA-, Protein- und Lipidschäden
- Schädigung: Lipidperoxidation, Proteinmodifikationen, mitochondriale Dysfunktion
Klinische Relevanz
- Rolle bei neurodegenerativen Erkrankungen (Alzheimer, Parkinson), Krebs und kardiovaskulären Erkrankungen
- Fördert Zellalterung durch DNA-Schäden und Telomerverkürzung
- Antioxidantien (z. B. Glutathion, Vitamin C/E) wirken protektiv
Synonyms -
Oxidativer Stress
|
|
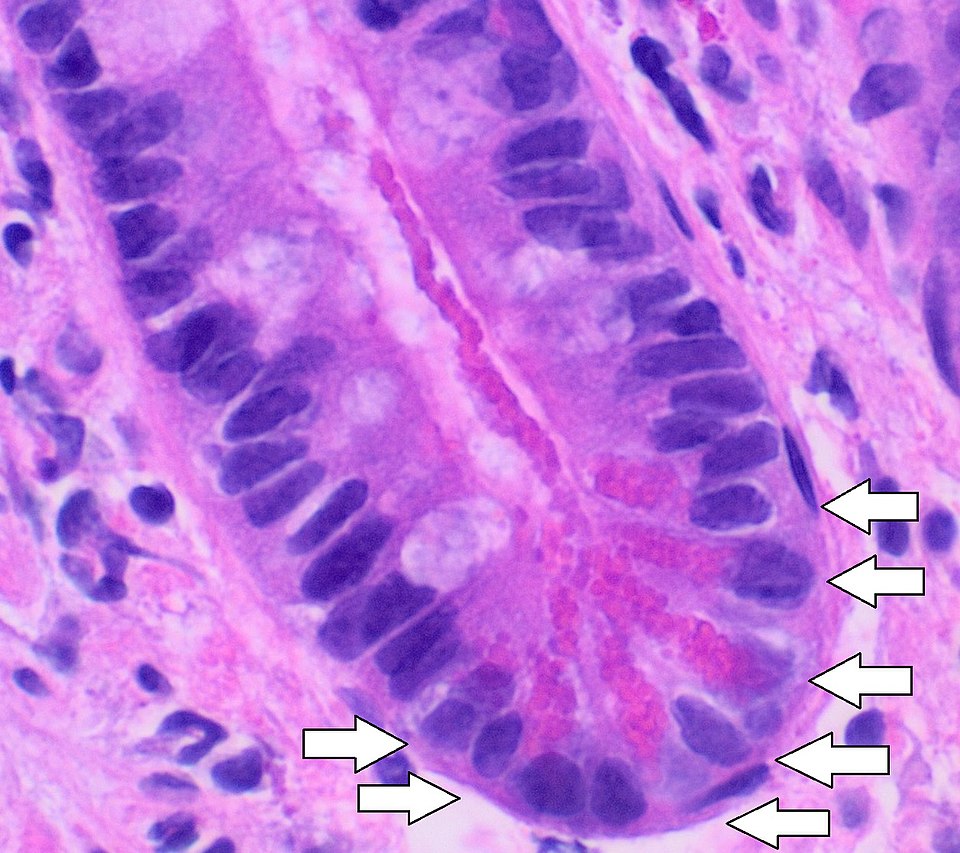
Oxyntische Mukosa
|
Die oxyntische Mukosa ist das Magenschleimhautepithel des Fundus und Corpus, das durch das Vorhandensein von Belegzellen (Parietalzellen) charakterisiert ist. Sie ist für die Produktion von Magensäure und intrinsischem Faktor essenziell.
Histologie und Zelltypen
- Belegzellen: Produzieren Salzsäure (HCl) und intrinsischen Faktor (essentiell für Vitamin B12-Resorption)
- Hauptzellen: Sekretieren Pepsinogen, Vorstufe des proteolytischen Enzyms Pepsin
- Endokrine Zellen: Produzieren Ghrelin, Somatostatin und Histamin (Regulation der Magensäuresekretion)
- Becherzellen: Kommen nur vereinzelt vor, sezernieren Schleim
Klinische Relevanz
Synonyms -
oxyntische Mukosa,oxynthische,oxyntisch, oxynthische Mukosa (Corpus, Fundus)
|
|
p40
|
p40 ist eine Isoform des Transkriptionsfaktors p63 und entsteht durch alternatives Spleißen des TP63-Gens. Es zeigt eine nukleäre Färbung und ist ein hochspezifischer Marker für Plattenepithelkarzinome.
Expression in Tumoren
- p40-positiv:
- p40-negativ:
Klinische Relevanz
- Höhere Spezifität als p63 für Plattenepithelkarzinome
- Ermöglicht die Differenzierung zwischen Plattenepithel- und Adenokarzinomen der Lunge
- Wichtiger Marker in der Pathologie des Urothels zur Beurteilung von Plattenepithel-Differenzierungen
|
|
p63
|
p63 ist ein nukleärer Transkriptionsfaktor aus der p53-Familie und spielt eine zentrale Rolle in der Proliferation, Differenzierung und Regeneration epithelialer Gewebe. Immunhistochemisch zeigt p63 eine nukleäre Färbung und dient als wichtiger Marker zur Identifikation von Plattenepithel- und myoepithelialen Zellen.
Expression in Tumoren
- p63-positiv:
- Plattenepithelkarzinome (p63+, CK5/6+, häufig p40+)
- Urothelkarzinome (p63+, GATA3+, CK7+, CK20+/-)
- Myoepitheliale Tumoren der Brust und Speicheldrüsen (p63+, SMA+, Calponin+)
- Basalzellkarzinome der Haut (p63+, BerEP4+, CK5/6+)
- p63-negativ:
Klinische Relevanz
- Wichtiger Marker zur Identifikation von Plattenepithelkarzinomen (p63+/p40+)
- Nützlich zur Abgrenzung von urothelialen und prostataepithelialen Tumoren
- Kombiniert mit p40 zur Bestätigung der Plattenepithelzell-Differenzierung
|
|
Paneth-Zellen
|
Paneth-Zellen sind spezialisierte exokrine Zellen des Dünndarms, die tief in den Krypten von Lieberkühn, insbesondere im Ileum, vorkommen. Sie spielen eine zentrale Rolle in der angeborenen Immunabwehr des Darms.
Morphologie und Lokalisation
- Lokalisiert in den Krypten des Dünndarms, seltener im Kolon bei chronisch-entzündlichen Darmerkrankungen (CED) als Paneth-Zell-Metaplasie
- Eosinophile, sekretorische Granula mit antimikrobiellen Peptiden
Molekulare Eigenschaften
- Produktion von Defensinen (α-Defensin 5 und 6), Lysozym und Phospholipase A2
- Expression von NOD2, wichtig für die bakterielle Erkennung und Immunantwort
- Wichtige Rolle bei der Darmflora-Homöostase und Barrierefunktion
Klinische Relevanz
|
|
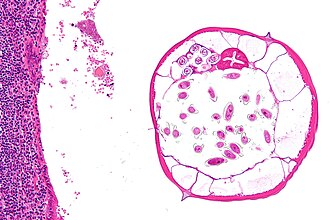
Parasiten
|
Parasiten sind Organismen, die auf Kosten eines menschlichen Wirts leben und sich von dessen Ressourcen ernähren, dabei potenziell Schäden verursachen. Sie können verschiedene Gewebe und Organsysteme befallen und eine Vielzahl von Erkrankungen auslösen.
Einteilung der Parasiten
- Protozoen (Einzellige Parasiten):
- Intestinal: Giardia lamblia, Entamoeba histolytica
- Blut-/Gewebsparasiten: Plasmodium spp. (Malaria), Trypanosoma spp. (Schlafkrankheit)
- Helminthen (Würmer):
- Nematoden (Rundwürmer): Ascaris lumbricoides, Strongyloides stercoralis, Enterobius vermicularis
- Trematoden (Saugwürmer): Schistosoma spp.
- Zestoden (Bandwürmer): Taenia solium, Echinococcus spp.
- Ektoparasiten (äußere Parasiten): Läuse, Milben (z. B. Sarcoptes scabiei, Erreger der Krätze)
Pathophysiologie
- Direkte Gewebeschädigung durch Zellinvasion und Toxine.
- Chronische Entzündungsreaktionen durch Immunaktivierung.
- Nährstoffraub führt zu Mangelerscheinungen (z. B. Eisenmangelanämie bei Hakenwurmbefall).
Klinische Relevanz
- Diagnostik über Mikroskopie, Serologie oder Molekulartests (PCR).
- Therapie abhängig vom Erreger, u. a. Metronidazol (Protozoen), Albendazol (Helminthen), Ivermectin (Ektoparasiten).
- Prävention durch Hygiene, Impfungen (z. B. Malaria-Forschung) und Antiparasitika.
Synonyms -
parasitär,parasitäre,parasitäres
|
|
Parietalzellen
|
Parietalzellen (Belegzellen) sind spezialisierte Zellen der Magenschleimhaut, die für die Produktion von Salzsäure (HCl) und Intrinsic Factor verantwortlich sind. Sie befinden sich in den Drüsen des Fundus und Korpus des Magens und spielen eine zentrale Rolle in der Verdauung und Vitamin-B12-Absorption.
Molekulare Mechanismen
- HCl-Sekretion: Reguliert durch den H+/K+-ATPase (Protonenpumpe)-Komplex in der apikalen Membran
- Stimulation:
- Gastrin: Bindet an CCK-B-Rezeptoren → Aktivierung der H+/K+-ATPase
- Histamin: Bindet an H2-Rezeptoren → cAMP-vermittelte Aktivierung
- Acetylcholin: Bindet an muskarinische M3-Rezeptoren → Aktiviert den IP3/Ca2+-Signalweg
- Hemmer: Protonenpumpen-Inhibitoren (PPI) wie Omeprazol blockieren die HCl-Sekretion
- Intrinsic Factor (IF): Glykoprotein, essenziell für die Vitamin-B12-Resorption im terminalen Ileum
Klinische Relevanz
- Parietalzellen sind Zielstrukturen bei der Behandlung von Gastritis, Ulkuskrankheit und Refluxerkrankung
- Autoimmunzerstörung führt zu atrophischer Gastritis mit Perniziöser Anämie (Vitamin-B12-Mangel)
- PPI-Therapie kann langfristig zu Hypochlorhydrie und Resorptionsstörungen führen
Synonyms -
Parietalzellverlust,Belegzelle,Belegzellen,Belegzellverlust
|
|
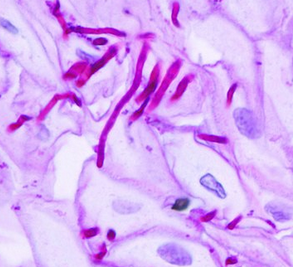
PAS
|
PAS (Periodic acid–Schiff) ist eine histochemische Färbung zur Darstellung von Polysacchariden wie Glykogen, Muzinen, Basalmembranen und Pilzen. Sie ist ein wichtiger Bestandteil der Diagnostik in Pathologie und Infektiologie.
Färbeprinzip
- Oxidation von 1,2-Glykolgruppen durch periodische Säure → Bildung von Aldehyden
- Reaktion mit Schiff-Reagenz → magenta-violette Färbung
- Nachweis von Glykogen, Muzinen, Pilzwänden, Basalmembranen
Typische Färbemuster
- Glykogen: Magenta (z. B. in Leberzellen)
- Basalmembranen: Deutlich positiv (z. B. in Niere)
- Pilze: Zellwände intensiv PAS-positiv
- Muzine: Nachweis in muzinösen Adenokarzinomen
Diagnostische Relevanz
- Nachweis von Speicherkrankheiten und Basalmembranveränderungen
- Tumordiagnostik: Mucin-Nachweis in Adenokarzinomen
- Pilzinfektionen: Erkennung invasiver Mykosen
Klinische Anwendungen
- Nephropathologie (z. B. Glomerulonephritiden)
- Lebererkrankungen mit Glykogenvermehrung
- Infektiologie: Candida-, Aspergillus-Nachweis
Synonyms -
PAS-Färbung,PAS-Reaktion
|
|
Pathogenese
|
Pathogenese bezeichnet die Entstehung und Entwicklung einer Erkrankung von den initialen Ursachen über molekulare und zelluläre Mechanismen bis hin zu den klinischen Manifestationen.
Grundlegende Mechanismen der Pathogenese
- Infektiöse Pathogenese: Vermehrung und Schädigung durch Mikroorganismen (z. B. bakterielle Toxine, virale Zytopathie).
- Entzündliche Pathogenese: Aktivierung des Immunsystems, Freisetzung proinflammatorischer Zytokine, Gewebeschädigung.
- Neoplastische Pathogenese: Genetische und epigenetische Veränderungen führen zu unkontrolliertem Zellwachstum.
- Degenerative Pathogenese: Alterungsprozesse, oxidative Schäden und Proteinfehlfaltung (z. B. Alzheimer, Arthrose).
- Autoimmunpathogenese: Dysregulierte Immunantwort gegen körpereigene Strukturen (z. B. Lupus erythematodes, Morbus Crohn).
Klinische Relevanz
- Verständnis der Pathogenese ist essenziell für die Entwicklung gezielter Therapieansätze.
- Präzise Pathogenesemodelle ermöglichen die Identifikation neuer Biomarker.
- Moderne Therapien greifen spezifisch in pathogenetische Mechanismen ein (z. B. PARP-Inhibitoren bei BRCA-mutierten Tumoren).
Synonyms -
pathogenetisch,pathogenetische
|
|
Pathologische Fraktur
|
Eine pathologische Fraktur ist ein Knochenbruch infolge struktureller Schwächung durch eine vorausgehende pathologische Veränderung des Knochens, meist ohne adäquates Trauma. Die Fraktur ist Ausdruck einer minderfesten Knochenstruktur und tritt oft spontan oder bei geringfügiger Belastung auf.
Ursachen
- Neoplastisch: Knochenmetastasen, Multiples Myelom, primäre Knochentumoren (z. B. Osteosarkom)
- Metabolisch: Osteoporose, Osteomalazie, Hyperparathyreoidismus
- Entzündlich: Chronische Osteomyelitis
- Genetisch: Osteogenesis imperfecta, M. Paget (in Spätstadien)
Pathologie
- Histologie: Frakturspalt, reaktive Umbauzonen, evtl. Tumorinfiltration oder Infektionszeichen
- Oft keine oder minimale Traumaassoziation in der Anamnese
Klinische Bedeutung
- Hinweis auf zugrunde liegende Erkrankung – Anlass zur differenzialdiagnostischen Abklärung
- Therapie richtet sich nach Frakturversorgung plus Behandlung der Grunderkrankung
- In onkologischen Fällen oft erstes Symptom einer malignen Grunderkrankung
|
|
PCR
|
PCR ( Polymerase-Kettenreaktion) ist ein in-vitro-Amplifikationsverfahren zur Vervielfältigung spezifischer DNA-Abschnitte. Entwickelt 1983 von Kary Mullis, bildet sie heute ein zentrales Werkzeug in der molekularen Pathologie, Mikrobiologie, Humangenetik und Tumordiagnostik.
Prinzip und Ablauf
- Die Methode basiert auf zyklischer Denaturierung der doppelsträngigen DNA, Annealing von spezifischen Primern und Elongation durch eine thermostabile DNA-Polymerase (z. B. Taq-Polymerase).
- Durch wiederholte Zyklen wird der Ziel-DNA-Abschnitt exponentiell amplifiziert.
Pathologische Relevanz
- Nachweis spezifischer Pathogene (z. B. HPV, CMV, Mycobacterium tuberculosis).
- Identifikation somatischer Mutationen in Tumorgewebe (z. B. KRAS-, EGFR-, BRAF-Mutationen).
- Erkennung minimaler Resterkrankung (MRD) in hämatologischen Neoplasien.
- Nachweis klonaler Umlagerungen bei Lymphomen (IGH-, TCR-Gen-Rearrangements).
Methodische Varianten
- RT-PCR: Nachweis von RNA durch vorherige Umwandlung in cDNA mittels Reverse Transkriptase.
- qPCR (Real-Time-PCR): Quantifizierung der DNA-Amplifikation in Echtzeit mittels Fluoreszenz.
- Digitale PCR: Hochsensitive Detektion seltener Mutationen durch absolute Quantifizierung.
Vorteile und Limitationen
- Vorteile: Hohe Sensitivität und Spezifität, kurze Durchlaufzeiten, geringe Probenmengen erforderlich.
- Limitationen: Anfällig für Kontamination, erfordert präzise Primerdesign, keine direkte Aussage über Proteinexpression.
Synonyms -
Polymerase-Kettenreaktion
|
|
PD-1
|
PD-1 (Programmed Death-1, syn. CD279, Gen: PDCD1 auf Chromosom 2q37.3) ist ein immunregulatorischer Rezeptor aus der CD28-Familie. Er wird auf aktivierten T- Zellen, B- Zellen und anderen Immunzellen exprimiert und dient als negativer Regulator der Immunantwort. Seine Hauptfunktion ist die Verhinderung von überschießenden Immunreaktionen und Autoimmunität.
Pathologische Relevanz
Diagnostik
- PD-1-Expression: Immunhistochemischer Nachweis auf tumorinfiltrierenden Lymphozyten.
- PD-L1-Expression: Bestimmung auf Tumorzellen zur Prädiktion der Wirksamkeit von Immun-Checkpoint-Inhibitoren.
Therapeutische Relevanz
- Checkpoint-Inhibitoren: Anti-PD-1-Antikörper wie Pembrolizumab, Nivolumab und Cemiplimab hemmen PD-1 und verstärken die T-Zell-Aktivität.
- Indikationen: Behandlung von NSCLC, Melanom, Nierenzellkarzinom, Hodgkin-Lymphom und anderen Tumoren.
- Resistenzmechanismen: Tumore können alternative Immunevasionsstrategien nutzen, z. B. durch TGF-β-vermittelte Immunmodulation.
Synonyms -
PD-1-Rezeptor,PD-1-Protein
|
|
PD-L1
|
PD-L1 (Programmed Death-Ligand 1, CD274-Gen auf Chromosom 9p24.1) ist ein membranständiges Protein, das eine Schlüsselrolle in der Immunregulation spielt. Durch die Bindung an den PD-1-Rezeptor auf T-Zellen hemmt PD-L1 die Immunantwort und ermöglicht Tumorzellen die Immunevasion.
Pathologische Relevanz
- PD-L1-Überexpression: Häufig in Tumoren wie NSCLC, Melanom, Urothelkarzinomen und Magenkarzinomen.
- Immunescape-Mechanismus: Tumorzellen nutzen PD-L1, um zytotoxische T-Zellen zu deaktivieren und der Immunabwehr zu entgehen.
- PD-L1-Expression als Biomarker: Korrelierte Expression mit Ansprechen auf Immun-Checkpoint-Inhibitoren.
Diagnostik
- Immunhistochemie (IHC): Bewertung der PD-L1-Expression mittels verschiedener Scores:
- Tumor Proportion Score (TPS): Anteil der PD-L1-positiven Tumorzellen in %.
- Combined Positive Score (CPS): Verhältnis aus PD-L1-positiven Tumor- und Immunzellen zur Gesamtzahl der Tumorzellen.
- Immune Cell Score (IC-Score): Bewertung der PD-L1-Expression auf Tumor-infiltrierenden Immunzellen, v. a. bei Urothelkarzinomen relevant.
- PD-L1-Expression: Cutoffs variieren je nach Tumorart und Therapie (z. B. TPS ≥1 % für NSCLC, CPS ≥10 für Magenkarzinome, IC-Score für Urothelkarzinome).
Therapeutische Relevanz
- Checkpoint-Inhibitoren: Anti-PD-1/PD-L1-Therapien wie Pembrolizumab, Nivolumab, Atezolizumab.
- Therapieentscheidung: PD-L1-Expression dient als Prädiktor für Immuntherapieansprechen, ist aber nicht immer allein aussagekräftig.
|
|
Penetranz
|
- Definition: Penetranz beschreibt das Ausmaß, in dem ein genetisches Merkmal (Genotyp) in einem Individuum zum Ausdruck kommt (Phänotyp).
- Komplette Penetranz: Wenn ein genetischer Defekt bei allen Trägern des entsprechenden Genotyps zum Ausdruck kommt (100%).
- Unvollständige Penetranz: Nicht alle Träger eines mutierten Gens zeigen das entsprechende Merkmal oder die Krankheit. Beispiel: Nur ein Teil der Individuen entwickelt Symptome trotz Vorliegen des Defekts.
- Ursachen:
- Genetische Variabilität
- Umweltfaktoren
- Epigenetische Modifikationen
- Bedeutung: Klinische Relevanz für die Risikoeinschätzung bei genetischen Erkrankungen.
- Beispiel: Hereditäre Brust- und Eierstockkrebs-Syndrome (BRCA1/BRCA2-Mutationen) können eine unvollständige Penetranz aufweisen – nicht jede betroffene Person erkrankt zwangsläufig.
|
|
Perineuralscheideninfiltration
|
Die Perineuralscheideninfiltration (PNI) beschreibt das Eindringen von Tumorzellen in oder entlang von peripheren Nerven und deren Hüllstrukturen (Perineurium). Sie ist ein häufiges Merkmal aggressiver Tumoren, wie z. B. Pankreas-, Prostata- und Kopf-Hals-Tumoren, und korreliert mit einer schlechteren Prognose, da sie die Tumorausbreitung und Schmerzsyndrome fördert.
Molekulare Mechanismen:
PNI wird durch eine komplexe Interaktion zwischen Tumorzellen, Nerven und der extrazellulären Matrix ermöglicht, darunter:
- Neurotrophine: Tumorzellen exprimieren und nutzen Neurotrophine (z. B. NGF, GDNF), die normalerweise Nervenwachstum fördern, um das Nervengewebe zu infiltrieren.
- Adhäsionsmoleküle: Moleküle wie NCAM und L1CAM erleichtern die Bindung von Tumorzellen an perineurale Strukturen.
- Proteasen: Matrix-Metalloproteinasen (MMPs) und Serinproteasen bauen die Perineuralscheidenmatrix ab und ermöglichen das Eindringen von Tumorzellen.
- Chemokinachsen: Interaktionen wie CXCR4/CXCL12 fördern die Migration von Tumorzellen entlang von Nerven.
Diese Mechanismen verdeutlichen, wie Tumorzellen das Nervengewebe aktiv nutzen, um ihre Ausbreitung zu erleichtern.
Synonyms -
Pn1
|