|
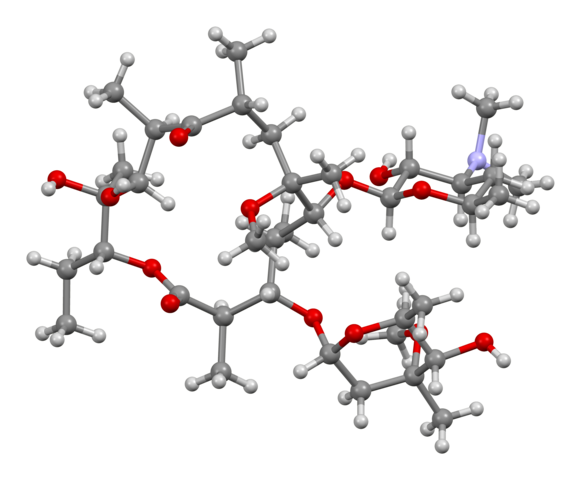
Clarithromycin
|
Clarithromycin ist ein Makrolid-Antibiotikum, das durch Hemmung der bakteriellen Proteinsynthese wirkt. Es besitzt ein breites Wirkspektrum gegen grampositive Kokken, einige gramnegative Bakterien und intrazelluläre Erreger wie Mykoplasmen und Chlamydien. Clarithromycin-Resistenz
Wirkmechanismus
- Bindet an die 50S-Untereinheit des bakteriellen Ribosoms
- Blockiert die Translokation während der Proteinsynthese
- Wirkt bakteriostatisch, kann in hohen Konzentrationen bakterizid sein
Indikationen
- Atemwegsinfektionen (z. B. atypische Pneumonien durch Mycoplasma pneumoniae, Legionellen)
- HNO-Infektionen (z. B. Tonsillitis, Sinusitis, Otitis media)
- Helicobacter-pylori-Eradikation in Kombinationstherapie
- Haut- und Weichteilinfektionen
Resistenzen und Wechselwirkungen
- Kreuzresistenz mit anderen Makroliden (z. B. Erythromycin, Azithromycin)
- Hemmt CYP3A4, dadurch zahlreiche Arzneimittelinteraktionen
Besondere Hinweise
- Gastrointestinale Nebenwirkungen häufig, selten QT-Zeit-Verlängerung
- Vorsicht bei Patienten mit Leberfunktionsstörungen
Synonyms -
Clarithromycin-Resistenz
|
|
CMV
|
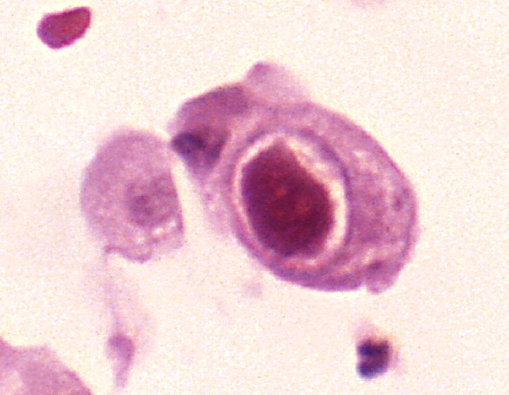
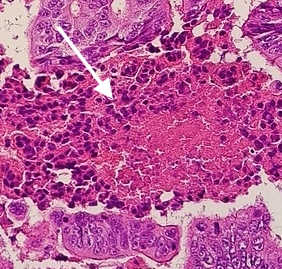
CMV (Zytomegalievirus, humanes Herpesvirus 5 / HHV-5) ist ein DNA-Virus aus der Herpesviridae-Familie. Es persistiert lebenslang im Körper und kann bei Immunsuppression reaktiviert werden. Aus pathologischer Sicht ist CMV besonders relevant bei Organtransplantierten, HIV-Patienten und Frühgeborenen.
Histologische Merkmale
- Charakteristische Einschlusskörperchen: große, eosinophile, meist intranukleäre Einschlusskörper mit perinukleärem Hof („Eulenaugenzellen“)
- Zusätzlich oft zytoplasmatische Einschlusskörper
- Nachweis in verschiedenen Geweben: Darm, Lunge, Leber, Niere, Retina
Pathologische Relevanz
- Gastrointestinaltrakt: CMV-Kolitis mit ulzerierenden Entzündungen, v. a. bei immunsupprimierten Patienten
- Lunge: interstitielle Pneumonie mit Entzündung und Einschlusskörperchen
- Leber: Hepatitis mit Einschlüssen in Endothelien und Hepatozyten
- Plazenta: intrauterine Infektion mit chronisch-entzündlichen Veränderungen
Nachweis
Klinische Bedeutung
- Wichtiger Erreger schwerer Infektionen bei Immunsuppression
- In der Transplantationspathologie ein häufiger Auslöser von Organabstoßung bzw. Funktionsverlust
- Therapie: Ganciclovir, Valganciclovir
Synonyms -
Zytomegalievirus,Cytomegalievirus, CMV-Infektion,CMV-positive,CMV-PCR,CMV-Gastritis
|
|
CMV-Kolitis
|
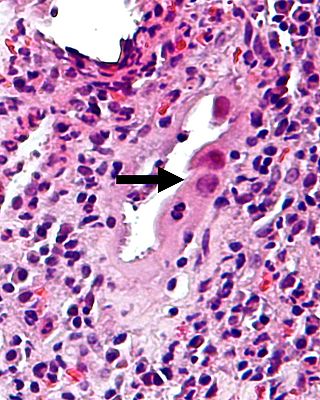
Die CMV-Kolitis ist eine entzündliche Dickdarmerkrankung, verursacht durch eine Infektion mit dem Zytomegalievirus (CMV), einem humanpathogenen Herpesvirus (HHV-5). Sie tritt vor allem bei immunsupprimierten Patienten auf, z. B. nach Transplantation, bei HIV oder Chemotherapie.
Pathologie
Histologie
- Vergrößerte Zellen mit prominenten, basophilen Kerneinschlüssen (Zytomegalie)
- Nachweis in HE möglich, aber bestätigend mittels IHC (CMV-Antigen) oder PCR
- Typischerweise im Ulkusgrund oder angrenzender Mukosa
Klinische Relevanz
- Immunsuppression: z. B. bei Organtransplantation, AIDS, hämatologischen Neoplasien
- Symptome: Fieber, blutige Diarrhö, abdominelle Schmerzen
- Wichtig: Abgrenzung von entzündlicher Grunderkrankung (z. B. M. ulcerosa mit Superinfektion)
- Therapie: Ganciclovir oder Foscarnet
Synonyms -
CMV-Colitis
|
|
Colitis ulcerosa
|
Colitis ulcerosa ist eine chronisch-entzündliche Darmerkrankung mit kontinuierlicher Mukosa- und Submukosaentzündung, beginnend im Rektum und potenziell das gesamte Kolon betreffend. Der Verlauf ist variabel mit schubförmigen oder progredienten Formen.
Verläufe
- Schubförmig-remittierend: Häufigste Form, wechselnde Schübe und Remissionen
- Chronisch-rezidivierend: Wiederkehrende Schübe mit unvollständiger Heilung
- Chronisch-progredient: Kontinuierliche Entzündung mit Schleimhautatrophie
- Fulminant: Schwere Kolitis mit Blutungen, toxischem Megakolon
Molekulare Mechanismen
- TH2-vermittelte Entzündung mit erhöhter IL-5- und IL-13-Aktivität
- HLA-assoziierte Prädisposition (HLA-DRB1)
- Erhöhte epitheliale Permeabilität → verstärkte Immunaktivierung
Pathologische Folgen
- Erhöhtes Risiko für kolorektales Karzinom bei langjähriger Erkrankung
- Toxisches Megakolon: Akute Dilatation mit Perforationsgefahr
- Blutungen: Schleimhautfragilität und Ulzerationen
Klinische Relevanz
- Histologische Abgrenzung zu Morbus Crohn
- Regelmäßige Dysplasie-Kontrollen bei chronischer Erkrankung
- Therapie: 5-ASA bei milden, Immunsuppressiva/Biologika bei schweren Verläufen
|
|
CTLA-4
|
CTLA-4 (Cytotoxic T-Lymphocyte-Associated Protein 4, syn. CD152, Gen: CTLA4 auf Chromosom 2q33.2) ist ein immunregulatorischer Rezeptor, der auf aktivierten T-Zellen exprimiert wird. Es gehört zur CD28-Familie und wirkt als negativer Regulator der T-Zell-Aktivierung, indem es die kostimulatorische Signalgebung hemmt.
Pathologische Relevanz
- CTLA-4/B7-Interaktion: CTLA-4 konkurriert mit CD28 um die Bindung an die kostimulatorischen Liganden CD80 (B7-1) und CD86 (B7-2) auf antigenpräsentierenden Zellen (APCs).
- Immunsuppression: Durch diese Interaktion wird die Aktivierung von T-Zellen gedämpft, was zur Immuntoleranz beiträgt.
- Autoimmunerkrankungen: Genetische Varianten von CTLA-4 sind mit Erkrankungen wie rheumatoider Arthritis, Typ-1-Diabetes und Hashimoto-Thyreoiditis assoziiert.
- Tumorimmunologie: Tumore nutzen die CTLA-4-vermittelte Immunsuppression, um der körpereigenen Abwehr zu entkommen.
Therapeutische Relevanz
- Checkpoint-Inhibitoren: Ipilimumab (Anti-CTLA-4-Antikörper) blockiert CTLA-4 und verstärkt die T-Zell-Aktivierung.
- Kombinationstherapie: CTLA-4-Inhibitoren werden oft mit PD-1-Inhibitoren (z. B. Nivolumab) kombiniert, um die Immunantwort zu maximieren.
- Indikationen: Ipilimumab ist zugelassen für das Melanom, nicht-kleinzelliges Lungenkarzinom (NSCLC) und Nierenzellkarzinom.
- Immunvermittelte Nebenwirkungen: Durch verstärkte T-Zell-Aktivierung kann es zu Autoimmunreaktionen kommen (z. B. Kolitis, Hepatitis, Endokrinopathien).
|
|
CTNNB1
|
CTNNB1 (Catenin Beta 1, Chromosom 3p22.1) kodiert für β-Catenin, ein Schlüsselprotein in der Zelladhäsion (über Cadherine) und im Wnt/β-Catenin-Signalweg. Onkogene Mutationen führen zu unkontrollierter Zellproliferation und Tumorentwicklung.
Onkogene Aktivierung
- Nukleäre β-Catenin-Expression als Marker: Normalerweise membranständig/zytoplasmatisch, nukleäre Akkumulation zeigt eine Wnt-Signalweg-Aktivierung an.
- Genetische Veränderungen:
Assoziierte Tumoren
Diagnostik
- Immunhistochemie (IHC): - Membranständig/zytoplasmatisch: Normal. - Nukleär: Pathologisch, Hinweis auf Wnt-Signalweg-Aktivierung.
- Genanalysen: Sequenzierung von CTNNB1, APC.
Therapeutische Relevanz
- Ansätze zur Hemmung der Wnt/β-Catenin-Signaltransduktion in Entwicklung.
Synonyms -
beta-Catenin,β-Catenin
|
|
Cyclooxigenase 2
|
Cyclooxygenase-2 (COX-2)
COX-2 (Cyclooxygenase-2, auch PTGS2) ist ein induzierbares Enzym der Arachidonsäurekaskade, das bei Entzündungsreaktionen, Gewebeschädigung und Tumorprozessen eine zentrale Rolle spielt. Es wird auf Chromosom 1q31.1 kodiert.
Funktion
- Katalysiert die Umwandlung von Arachidonsäure zu Prostaglandin H₂ (PGH₂), dem gemeinsamen Vorläufer aller Prostaglandine und Thromboxane
- PGH₂ wird anschließend durch zellspezifische Enzyme in PGE₂, PGI₂, TXA₂ etc. umgewandelt
- Reguliert Entzündung, Schmerz, Fieber sowie Zellproliferation und Apoptosehemmung
Pathologische Relevanz
Klinische Relevanz
- Zielstruktur für nichtsteroidale Antirheumatika (NSAR) und selektive COX-2-Inhibitoren wie Celecoxib
- Untersucht in der Krebsprävention, z. B. bei FAP oder chronisch-entzündlichen Darmerkrankungen
- Immunhistochemische COX-2-Darstellung kann in bestimmten Tumoren diagnostisch oder forschungsrelevant sein
Synonyms -
Cyclooxigenase-2,COX-2,COX2
|
|
Cyclooxigenase1
|
Cyclooxigenase-1 (COX-1)
COX-1 (Cyclooxygenase-1) ist ein konstitutiv exprimiertes Enzym der Prostaglandinsynthese und gehört zur Familie der Prostaglandin-Endoperoxid-Synthasen. Es katalysiert die Umwandlung von Arachidonsäure in Prostaglandin H2, einen zentralen Vorläufer für verschiedene Prostaglandine, Prostacyclin und Thromboxan A2.
Physiologische Funktion
- Schutz der Magenschleimhaut durch Förderung der Schleim- und Bicarbonatsekretion sowie Aufrechterhaltung der lokalen Durchblutung
- Regulation der Nierendurchblutung, insbesondere bei vermindertem Blutfluss (z. B. Hypovolämie)
- Förderung der Thrombozytenaggregation über Bildung von Thromboxan A2
- Stabilisierung physiologischer Funktionen in ZNS, Lunge, Uterus und Magen-Darm-Trakt
Pathologische Relevanz
- Hemmung durch nicht-selektive NSAR wie Acetylsalicylsäure, Ibuprofen, Diclofenac → vermindert Prostaglandinsynthese in Magen und Niere
- Folge: Schleimhautschäden, Ulzera, gastrointestinale Blutungen, reduzierte Nierenperfusion
- Im Gegensatz zu COX-2 nicht primär entzündungsinduziert, sondern homöostatisch aktiv
Klinische Relevanz
- Basis für Entwicklung selektiver COX-2-Inhibitoren (z. B. Celecoxib), um COX-1-vermittelte Nebenwirkungen zu vermeiden
- Irreversible COX-1-Hemmung durch ASS in Thrombozyten → antithrombotische Langzeitwirkung
- COX-1 bleibt bei den meisten entzündlichen Reaktionen konstant exprimiert
Synonyms -
Cyclooxygenase-1 (COX-1),Cyclooxigenase-1,COX-1,COX1,Cyclooxigenase-1
|
|
Darmflora
|
Darmflora (intestinales Mikrobiom) bezeichnet die Gesamtheit der im Darm lebenden Mikroorganismen, die eine zentrale Rolle in der Verdauung, Immunregulation und Stoffwechselprozessen spielen. Sie besteht hauptsächlich aus Bakterien, aber auch aus Archaeen, Viren und Pilzen.
Zusammensetzung
- Hauptgruppen: Firmicutes, Bacteroidetes, Actinobacteria, Proteobacteria
- Individuell variabel, beeinflusst durch Ernährung, Genetik und Umweltfaktoren
Funktionen
- Verdauung: Spaltung komplexer Kohlenhydrate, Produktion von kurzkettigen Fettsäuren (SCFA)
- Immunmodulation: Regulation der mukosalen Immunantwort, Toleranzentwicklung
- Schutzfunktion: Verdrängung pathogener Keime durch Kolonisationsresistenz
- Metabolismus: Einfluss auf Glukose- und Fettstoffwechsel, Vitaminproduktion (z. B. K, B12)
Klinische Relevanz
- Dysbiose (Ungleichgewicht der Darmflora) ist mit Erkrankungen wie CED, Reizdarmsyndrom, Adipositas und metabolischem Syndrom assoziiert.
- Therapeutische Ansätze: Probiotika, Präbiotika, Fäkaltransplantation
|
|
Debris
|
Debris (lat. „Trümmer“) bezeichnet in der Pathologie nicht mehr intakte Zell- oder Gewebestrukturen, die im Rahmen von Nekrose, Entzündung oder Abstoßungsreaktionen entstehen. Es handelt sich um zelluläre Zerfallsprodukte, bestehend aus den Resten von Zellkernen, Zytoplasma, Zellmembranbestandteilen und extrazellulären Proteinen.
Histologische Merkmale
- Granuläres bis amorphes Material, eosinophil in der HE-Färbung
- Oft durchsetzt von neutrophilen Granulozyten, Fibrin oder nekrotischem Gewebe
- Typisch bei eitrigen Entzündungen, ischämischer Nekrose oder ulzerierten Tumoren
Klinisch-pathologische Relevanz
- Hinweis auf akuten Gewebeuntergang oder starke Entzündungsreaktion
- In Abszessen, Ulzera, Nekrosen oder auf der Oberfläche von Karzinomen nachweisbar
- In der Zytologie auch als „zellulärer Schmutz“ (dirty background) bezeichnet
|
|
Diabetes mellitus
|
Diabetes mellitus ist eine chronische Stoffwechselerkrankung, die durch eine gestörte Glukosehomöostase infolge eines absoluten oder relativen Insulinmangels gekennzeichnet ist. Die Folge sind Hyperglykämie-bedingte Zell- und Gewebeschäden.
Pathogenese
- Diabetes Typ 1: Autoimmunbedingte Zerstörung der Betazellen des Pankreas (HLA-Assoziation)
- Diabetes Typ 2: Insulinresistenz mit kompensatorischer Hyperinsulinämie, später Betazell-Erschöpfung
- AGEs (Advanced Glycation Endproducts): Nicht-enzymatische Glykierung von Proteinen, DNA und Lipiden → Zellschädigung, Entzündung, Gefäßversteifung
Folgeerkrankungen
- Makroangiopathie: Atherosklerose mit erhöhtem Risiko für Myokardinfarkt und Schlaganfall
- Mikroangiopathie: Diabetische Nephropathie, Retinopathie, Neuropathie
- Diabetisches Fußsyndrom: Chronische Wundheilungsstörungen, Infektionen, Gangrän
Pathologische Veränderungen
- Pankreas: Insulinitis (Typ 1), Amyloidablagerungen in den Langerhans-Inseln (Typ 2)
- Gefäße: Hyaline Arteriolosklerose, endotheliale Dysfunktion
- Organschäden: Glomerulosklerose, Retina-Mikroaneurysmen, periphere Nervenfaserdegeneration
Klinische Relevanz
- Diabetes ist ein multisystemisches Krankheitsbild mit hohem Morbiditäts- und Mortalitätsrisiko
- Früherkennung und metabolische Kontrolle sind entscheidend zur Vermeidung irreversibler Schäden
- AGEs spielen eine zentrale Rolle in der Langzeitschädigung diabetischer Patienten
|
|
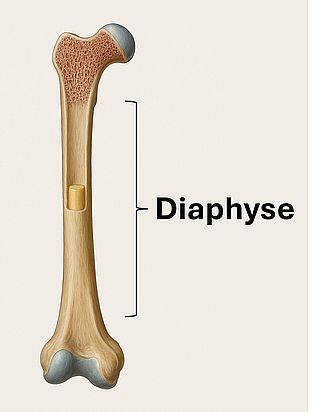
Diaphyse
|
Die Diaphyse ist der mittlere, zylindrische Schaftanteil eines Röhrenknochens. Sie besteht primär aus kompaktem (kortikalem) Knochen und umgibt die Markhöhle, in der sich rotes oder gelbes Knochenmark befindet. Die Diaphyse ist für die mechanische Stabilität und Kraftübertragung verantwortlich.
Histologischer Aufbau
- Kortikalis: Kompakter Lamellenknochen, hohe Druck- und Biegefestigkeit
- Endost: Innere Knochenhaut, grenzt an die Markhöhle, osteogen aktiv
- Periost: Äußere Knochenhaut mit vaskulären und nervalen Strukturen
- Markraum: Mit Fett (gelbes Mark) oder Hämatopoese (rotes Mark) gefüllt
Klinisch-pathologische Bedeutung
- Typische Lokalisation für bestimmte Knochentumoren (z. B. Ewing-Sarkom, Osteoidosteom)
- Bei Frakturen oder Infektionen (Osteomyelitis) relevante anatomische Zone
- Ort für intramedulläre Markrauminterventionen (z. B. Biopsie, Marknagel)
Synonyms -
diaphysär
|
|
Diarrhö
|
Diarrhö bezeichnet eine pathologisch gesteigerte Stuhlfrequenz (mehr als 3 Stuhlgänge pro Tag) mit vermehrtem Wassergehalt (>75 %) und erhöhter Stuhlmenge (>200–250 g/Tag). Sie ist ein Leitsymptom zahlreicher gastrointestinaler Erkrankungen und kann akut oder chronisch verlaufen.
Pathophysiologische Typen
- Osmotische Diarrhö: Unverdauliche oder osmotisch aktive Substanzen ziehen Wasser in das Darmlumen (z. B. Laktoseintoleranz, Abführmittel).
- Sekretorische Diarrhö: Erhöhte Sekretion von Elektrolyten und Wasser (z. B. bakterielle Toxine wie bei Vibrio cholerae oder C. difficile).
- Exsudative Diarrhö: Entzündliche Mukosaschäden führen zu Schleim-, Blut- und Proteinverlusten (z. B. bei chronisch-entzündlichen Darmerkrankungen, infektiöser Kolitis).
- Motilitätsbedingte Diarrhö: Beschleunigte Darmpassage reduziert die Resorptionszeit (z. B. Reizdarm, Hyperthyreose).
Pathologische Relevanz
- Diarrhö ist ein häufiges Symptom bei infektiösen Kolitiden, Malabsorptionssyndromen, entzündlichen Darmerkrankungen sowie bei funktionellen Störungen.
- Chronische Diarrhö kann zu Malnutrition, Dehydratation und Elektrolytstörungen führen.
Histologie (bei chronischer Diarrhö)
- Histopathologische Veränderungen abhängig von der Grunderkrankung:
Diagnostik
- Stuhlanalyse (Mikrobiologie, Toxine, Entzündungsmarker, Fettgehalt).
- Endoskopie mit gezielter Biopsie zur histologischen Abklärung bei chronischer oder unklarer Diarrhö.
Therapeutische Relevanz
- Zielgerichtete Therapie je nach Ätiologie: antimikrobiell, antiinflammatorisch, diätetisch oder symptomatisch.
- Wichtig: Volumen- und Elektrolytausgleich, besonders bei akuter schwerer Diarrhö.
|
|
Differenzierung
|
In der Pathologie bezeichnet Differenzierung den Grad, in dem Zellen strukturelle und funktionelle Merkmale ihres Ursprungsgewebes aufweisen. Sie kann sich sowohl auf normale Gewebe als auch auf neoplastische Prozesse beziehen.
Physiologische Differenzierung
- Zellen entwickeln spezialisierte Eigenschaften entsprechend ihrer Funktion (z. B. glattmuskuläre, epitheliale oder neuronale Differenzierung)
- Wichtig für Geweberegeneration und -homöostase
Neoplastische Differenzierung
Klinische Relevanz
- In Tumoren als prognostischer Faktor entscheidend
- Hilft in der Immunhistochemie, Zelllinien oder Tumorentitäten zu identifizieren
- Ermöglicht Differenzierung zwischen benignen und malignen Läsionen
Synonyms -
differenziert, differenzierte, differenziertes,differenzierten
|
|
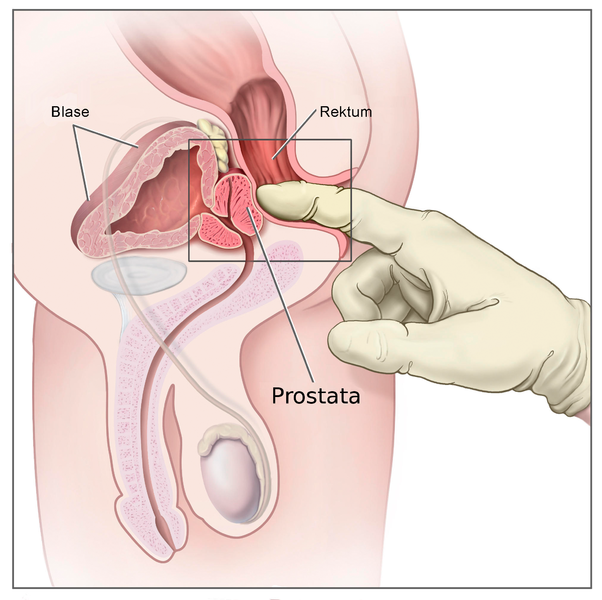
Digitale rektale Untersuchung
|
Die digitale rektale Untersuchung (DRU) ist eine manuelle Methode zur Abtastung der Prostata über den Enddarm. Sie dient der Beurteilung von Größe, Konsistenz und Oberfläche der Prostata, um Veränderungen wie Knoten, Verhärtungen oder Asymmetrien zu erkennen. Die DRU ist ein wichtiger Bestandteil der Früherkennung von Erkrankungen wie benigner Prostatahyperplasie (BPH) oder Prostatakarzinom, wird jedoch oft durch weitere diagnostische Verfahren ergänzt.
Synonyms -
DRU
|